脂質(zhì)體��、外泌體等納米制劑在疾病治療領(lǐng)域已有廣泛應(yīng)用����,但仍存在體內(nèi)停留時間短、清除速率快等挑戰(zhàn)�,合適的遞送載體可改善其體內(nèi)行為,達(dá)到更好的治療效果�。關(guān)于藥物分子的遞送研究已持續(xù)幾十年,而對于納米粒遞送的研究卻極少���,且分子水平的治療劑適用的載體通常無法遞送納米粒�����。所以�����,制備生物安全����、具有開放孔道�����、孔徑在納米尺度范圍的多孔載體,用于納米粒的遞送���,將為藥物遞送開辟新思路����。
2024年1月30日����,中國科學(xué)院上海藥物研究所張繼穩(wěn)團(tuán)隊(duì)與沈陽藥科大學(xué)王淑君團(tuán)隊(duì)聯(lián)合在Small Structures上發(fā)表了題為“Supramolecular Nano-Grid Platform to Load and Deliver Liposomes and Exosomes”的研究論文。該研究以環(huán)糊精為基本結(jié)構(gòu)單元�����,構(gòu)建了一種新型的納米網(wǎng)格結(jié)構(gòu)載體����,其不僅具有pH/H2O2雙響應(yīng)性,還能通過多孔網(wǎng)狀的納米結(jié)構(gòu)負(fù)載脂質(zhì)體和外泌體:將脂質(zhì)體靶向遞送到肺部并延長其體內(nèi)作用時間�,實(shí)現(xiàn)外泌體遞送并達(dá)到長時間釋放效果。
研究人員基于環(huán)糊精金屬有機(jī)骨架的有序結(jié)構(gòu)���,針對環(huán)糊精單元上不同位點(diǎn)的羥基活性差異��,采用對稱型硼酸酯鍵交聯(lián)劑����,對其進(jìn)行交聯(lián)���,通過控制反應(yīng)條件��,得到納米網(wǎng)格狀和球形兩種不同結(jié)構(gòu)特征的硼化有機(jī)骨架(BOF)�����。其中����,納米網(wǎng)格狀結(jié)構(gòu)由數(shù)十納米直徑的纖維交織而成�����,分布有10-300 nm的開放空間�����。硼酸酯鍵交聯(lián)劑賦予BOF以pH/H2O2雙響應(yīng)性�����,其在生理pH環(huán)境下穩(wěn)定、在炎癥或腫瘤內(nèi)環(huán)境下迅速降解��,在pH 7.4時的半衰期是pH 5.0的467倍�,H2O2存在時降解速率顯著加快。
納米網(wǎng)格結(jié)構(gòu)和球狀結(jié)構(gòu)的BOF
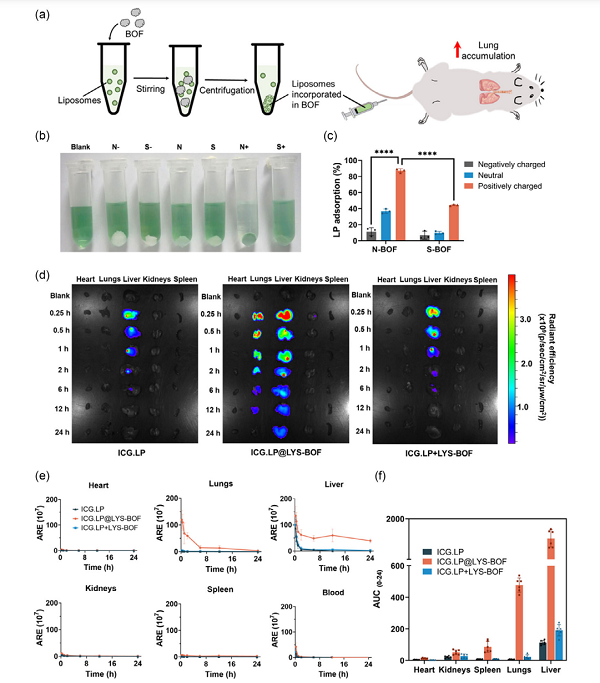
研究表明���,納米網(wǎng)格狀結(jié)構(gòu)的BOF(N-BOF)比球狀BOF(S-BOF)具有更好的脂質(zhì)體俘獲效果����,并能顯著改變脂質(zhì)體在小鼠體內(nèi)的生物分布:游離脂質(zhì)體在肺部幾乎沒有分布�����,負(fù)載于N-BOF后�,脂質(zhì)體在肺部的熒光信號顯著增強(qiáng),肺部生物利用度提高約90倍��。
N-BOF的脂質(zhì)體負(fù)載能力及對脂質(zhì)體生物分布的影響
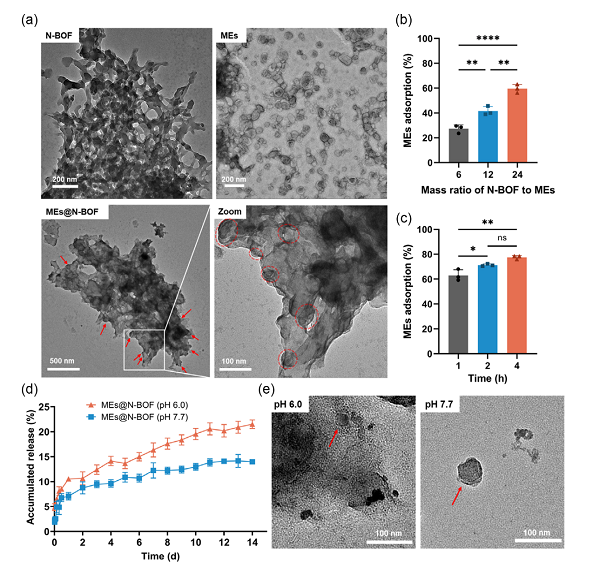
牛奶外泌體的粒徑為50-150 nm����,處于N-BOF孔徑的主要分布范圍內(nèi)。N-BOF對牛奶外泌體具有良好的俘獲效果�����,利用透射電鏡可以觀察到脂質(zhì)雙層結(jié)構(gòu)的外泌體分布在N-BOF顆粒上。N-BOF能夠響應(yīng)性釋放所負(fù)載的外泌體���,在pH 7.7環(huán)境中��,14天內(nèi)N-BOF對外泌體的釋放量為14%�,而pH 6.0環(huán)境下釋放量則為21%�����,且釋放出的外泌體仍能保持完整的結(jié)構(gòu)�。
N-BOF對牛奶外泌體的俘獲及pH響應(yīng)性釋放
上海藥物所碩士研究生李晶為本文第一作者���,上海藥物所碩士研究生馬武珍進(jìn)行了外泌體部分的研究�,沈陽藥科大學(xué)博士研究生楊伯陽完成脂質(zhì)體制備����。上海藥物所張繼穩(wěn)研究員、伍麗副研究員和沈陽藥科大學(xué)王淑君教授為本文共同通訊作者����。該研究得到了國家自然科學(xué)基金和國家重點(diǎn)研發(fā)計劃等項(xiàng)目的資助。