蛋白質(zhì)的化學(xué)修飾可改善蛋白的理化性質(zhì),賦予蛋白新的生理學(xué)功能����,比如延長(zhǎng)半衰期、標(biāo)記靶標(biāo)受體��、調(diào)節(jié)蛋白-蛋白相互作用等�����,在生物技術(shù)及藥學(xué)研究中具有重要的意義�。相較于蛋白質(zhì)氨基酸側(cè)鏈及N端修飾技術(shù)的蓬勃發(fā)展,蛋白質(zhì)C端修飾策略仍比較匱乏��。其中����,經(jīng)典的C端修飾方法主要為化學(xué)酶法,需要在目標(biāo)蛋白質(zhì)的C端融合特定標(biāo)簽���,利用酶催化反應(yīng)將合成的含有相應(yīng)氨基酸序列的修飾片段共價(jià)偶聯(lián)到蛋白質(zhì)的C端��,具有一定的限制���。另外,基于化學(xué)手段的蛋白質(zhì)C端修飾方法還很缺乏��。因此����,開發(fā)新型的、純化學(xué)的�、底物范圍廣泛的C端修飾策略具有重要意義。
在此基礎(chǔ)上����,中國(guó)科學(xué)院上海藥物研究所黃蔚課題組于2023年11月7日在 Nature Communications發(fā)表了題為“C-terminal modification and functionalization of proteins via a self-cleavage tag triggered by a small molecule”的研究論文。
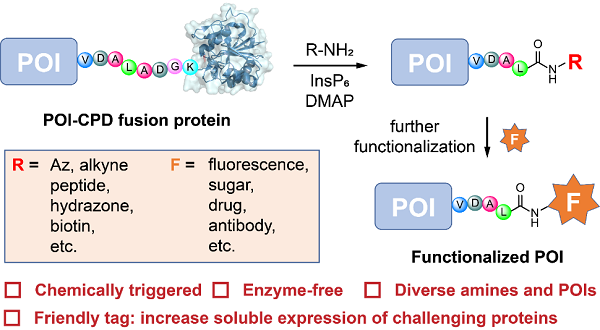
半胱氨酸蛋白酶結(jié)構(gòu)域(CPD)已被廣泛用作蛋白質(zhì)C端標(biāo)簽以提高目標(biāo)蛋白的可溶性表達(dá)��。與其他標(biāo)簽相比���,催化量的肌醇六磷酸(InsP 6)即可實(shí)現(xiàn)CPD標(biāo)簽的脫除����。結(jié)合前期工作,研究人員推測(cè)在CPD的自裂解過程中可能存在硫酯中間體���。因此����,團(tuán)隊(duì)推測(cè)額外加入的氨基化合物可與硫酯中間體反應(yīng)形成新的酰胺鍵�,在標(biāo)簽脫除的同時(shí)實(shí)現(xiàn)對(duì)蛋白質(zhì)C端的衍生化。
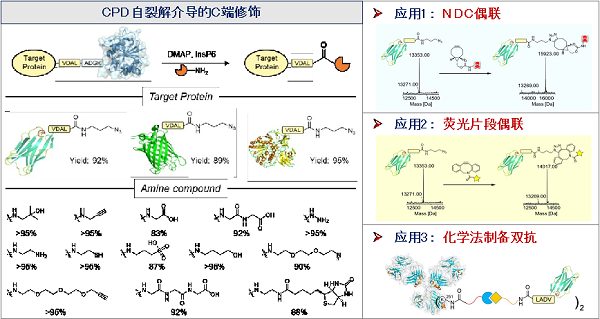
在本研究中�,科研人員首先從氨基化合物濃度、InsP 6濃度�、催化劑種類、緩沖溶液種類等多方面對(duì)反應(yīng)條件進(jìn)行了優(yōu)化����,并對(duì)氨基底物以及蛋白底物進(jìn)行了拓展,轉(zhuǎn)化率最高可達(dá)95%以上�����。研究人員應(yīng)用該策略實(shí)現(xiàn)了納米抗體藥物偶聯(lián)物����、納米抗體糖/肽偶聯(lián)物���、雙特異性抗體的制備以及抗體C端的熒光標(biāo)記�,展示了該策略具有廣泛的應(yīng)用場(chǎng)景。
圖1. 小分子觸發(fā)的蛋白質(zhì)C端修飾及功能化
該方法通過化學(xué)手段實(shí)現(xiàn)了蛋白的快速功能化�,具有無(wú)需酶催化、位點(diǎn)特異性好�、修飾效率高、底物范圍廣等優(yōu)點(diǎn)�,為當(dāng)前蛋白C端修飾手段匱乏提供了有力的補(bǔ)充,具有較大的應(yīng)用潛力����。
圖2. 新方法具有良好的蛋白質(zhì)、氨基底物兼容性以及廣泛的應(yīng)用場(chǎng)景
上海藥物所博士研究生曾悅����、施偉副研究員為論文共同第一作者,唐峰研究員為論文通訊作者�����,黃蔚研究員給予了大力支持��。本研究得到了國(guó)家重點(diǎn)研發(fā)計(jì)劃項(xiàng)目、國(guó)家自然科學(xué)基金���、上海市“揚(yáng)帆計(jì)劃”��、中國(guó)科學(xué)院特別研究助理項(xiàng)目�、中國(guó)博士后科學(xué)基金���、杭州創(chuàng)新創(chuàng)業(yè)領(lǐng)導(dǎo)團(tuán)隊(duì)項(xiàng)目及臨港實(shí)驗(yàn)室等項(xiàng)目的基金支持�。